中國(guó)創新藥發展迅猛,同靶點影(yǐng)響試驗效率
- 分(fēn)類:行業動态
- 作(zuò)者:
- 來(lái)源:生(shēng)物制藥小編
- 發布時間:2022-05-20
- 訪問(wèn)量:171
【概要描述】中國(guó)的監管改革促進了本土(tǔ)醫療創新。獲批IND和獲批NDA數量的趨勢以及這些批準所花費的時間表明,這些變更的影(yǐng)響通常是有益的。盡管如(rú)此,具有相(xiàng)同靶點的多個産品的聚集和低效的臨床試驗過程将影(yǐng)響真正有意義的創新藥物從(cóng)IND到NDA批準的進程。
中國(guó)創新藥發展迅猛,同靶點影(yǐng)響試驗效率
【概要描述】中國(guó)的監管改革促進了本土(tǔ)醫療創新。獲批IND和獲批NDA數量的趨勢以及這些批準所花費的時間表明,這些變更的影(yǐng)響通常是有益的。盡管如(rú)此,具有相(xiàng)同靶點的多個産品的聚集和低效的臨床試驗過程将影(yǐng)響真正有意義的創新藥物從(cóng)IND到NDA批準的進程。
- 分(fēn)類:行業動态
- 作(zuò)者:
- 來(lái)源:生(shēng)物制藥小編
- 發布時間:2022-05-20
- 訪問(wèn)量:171
在過去(qù)十年(nián)中,由于監管改革,中國(guó)新藥的臨床開發和監管審查過程發生(shēng)了實質性變化。這些改革旨在鼓勵開發創新産品,特别是罕見(jiàn)、嚴重或危及生(shēng)命的疾病,并确保患者及時獲得(de)這些治療。

2010-2020年(nián)新藥趨勢
首次IND申請(qǐng)數量急劇(jù)增加。2010年(nián)至2020年(nián),共提交了1636個創新藥的首次IND申請(qǐng),年(nián)均增長率爲32%(圖1a)。其中,1 410種藥物(86%)來(lái)自(zì)689家當地公司。值得(de)注意的是,2017年(nián)創新藥首次IND申報數量較2016年(nián)增長78%,其中化學藥品和治療用生(shēng)物制品分(fēn)别增長60%和159%。
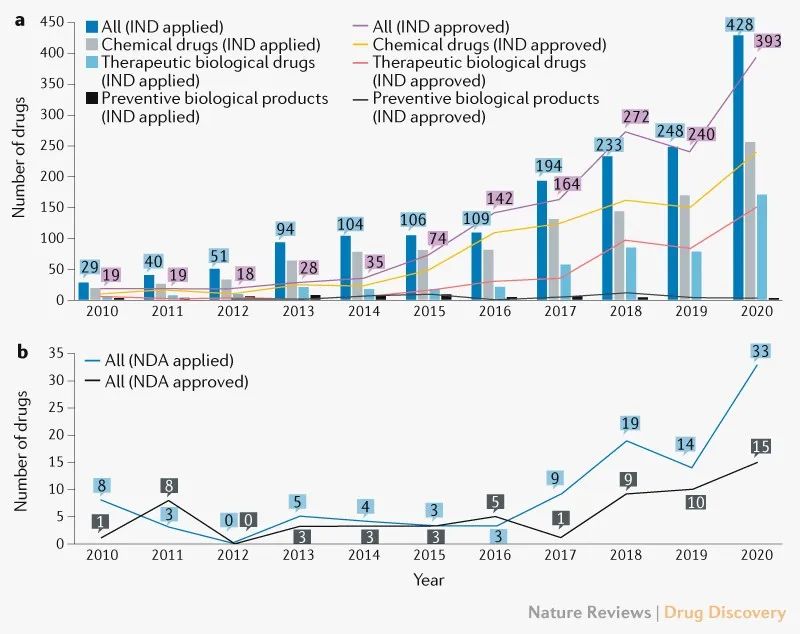
圖1|中國(guó)創新藥年(nián)度IND和NDA數量
在1,466例完成的首次IND審查中,1,404例(96%)獲得(de)批準。拒絕原因主要包括申報後缺乏研究信息導緻溝通無效、藥物臨床獲益風(fēng)險比不合理(lǐ)、違背臨床診斷基本原則等。首次獲批IND的創新藥數量每年(nián)增加35%,其中2016年(nián)首次獲批IND的創新藥明顯增加。
申報和批準的創新藥首次IND數量顯著增加,與2015年(nián)7月中國(guó)監管改革措施出台的時間相(xiàng)一緻,緩解了申報積壓,鼓勵了醫藥創新。
創新藥物的獲批NDA數量較少,但(dàn)在不斷增長。2010年(nián)至2020年(nián)提交了101個創新藥的NDA,58個創新藥獲得(de)批準。近年(nián)來(lái),提交和批準的NDA數量普遍在增加(圖1b),自(zì)2015年(nián)7月以來(lái),58個批準的創新藥物中有42個(72%)獲得(de)批準。
在完成的66項首次NDA審查中,58項(88%)獲得(de)批準。拒絕的主要原因是藥物或臨床研究設計(jì)存在重大(dà)缺陷,不同發育階段使用的試驗樣品不一緻,檢查中發現的臨床試驗數據不真實。
在58個獲批的創新藥中,37個爲中國(guó)國(guó)家藥品監督管理(lǐ)局(NMPA)批準的新分(fēn)子實體(tǐ)(NME),而21個爲國(guó)外已批準或上市的藥物,或傳統疫苗、血液制品、細胞因子等。此外,14例(24%)爲孤兒藥,其中13例根據美國(guó)FDA的标準有資格作(zuò)爲孤兒藥。再者,40個創新藥(69%)獲得(de)優先審評,其中35個(88%)在2015年(nián)7月後獲得(de)批準。數據顯示,2015年(nián)8月出台的優先審評等監管改革措施,鼓勵組織創新。
腫瘤是創新藥物的主要領域,大(dà)多數處于早期開發階段。首次IND申請(qǐng)獲批的創新藥物的主要治療類别爲腫瘤(864,62%)、感染(166,12%)、内分(fēn)泌紊亂(72,5%)和心血管疾病(60,4%)。2016年(nián)首次IND申請(qǐng)獲批的腫瘤藥物數量明顯增加,增長率爲133%。
在首次IND申請(qǐng)獲批的創新藥中,705個(50%)至少達到I期,而286個(20%)和108個(8%)藥物分(fēn)别達到II期和III期。大(dà)多數抗癌藥物(57%)尚未進展超過I期(圖2a)。
圖2|創新藥發展狀況
我國(guó)主要處于快(kuài)速跟蹤、逐步創新階段,獲批NDA的創新藥物隻有3個‘首創’:苯維莫德、低聚甘露糖酸鈉和羅沙司他(tā)。有超過40種靶向EGFR、PDL1和HER2的藥物(圖2b),其中EGFR的獲批藥物數量(4種)和已達到臨床試驗的藥物數量(64種)最高。多個靶點和适應症相(xiàng)同的藥物會降低創新效率。
IND和NDA審批速度提高,但(dàn)臨床試驗速度沒有提高。如(rú)圖3所示,改革後階段(2015年(nián)7月至2020年(nián)12月)的IND批準時間比改革前階段(2010年(nián)1月至2015年(nián)6月)短(duǎn)414天(87天vs. 501天)。同樣,改革後階段藥品的NDA批準階段比改革前階段短(duǎn)441天(483天與924天)。
圖3|2010-2020年(nián)期間批準的創新藥物的時間
2018年(nián)7月,國(guó)家藥品監督管理(lǐ)局将開始藥物臨床試驗的審批流程調整爲默示許可(kě)制度。就(jiù)整個臨床試驗階段的時長(2,572天與2,688天)而言,兩個研究階段的差異不顯著,而改革後階段IND批準後入組臨床試驗首例受試者的時間比改革前階段長59天(328天vs 269天)。提高臨床試驗效率是我國(guó)鼓勵創新的重要改革方向。但(dàn)這受倫理(lǐ)審查效率、研究者經驗和臨床試驗資源等多因素的影(yǐng)響,需要對國(guó)家臨床試驗能力進行戰略升級來(lái)解決。再者,目前靶點和适應症相(xiàng)同的藥物集中在同一臨床試驗階段,加重了對臨床試驗效率的影(yǐng)響。
中國(guó)的監管改革促進了本土(tǔ)醫療創新。獲批IND和獲批NDA數量的趨勢以及這些批準所花費的時間表明,這些變更的影(yǐng)響通常是有益的。盡管如(rú)此,具有相(xiàng)同靶點的多個産品的聚集和低效的臨床試驗過程将影(yǐng)響真正有意義的創新藥物從(cóng)IND到NDA批準的進程。
參考文獻:
https://www.nature.com/articles/d41573-022-00077-3
掃二維碼用手機(jī)看(kàn)
推薦新聞
關注我們

關注官方微信公衆号
或搜索“東方百泰”
更多精彩等着你(nǐ)!






